Neun mit EdrawMax erstellte, speziell für das deutsche Bildungswesen konzipierte, inspirierende Lernvorlagen führen Sie auf eine faszinierende Reise durch die Welt der Chemie. Alle Vorlagen entsprechen den aktuellen Bildungsstandards der Kultusministerkonferenz (KMK) der Bundesrepublik Deutschland sowie den Curricula aller deutschen Bundesländer und eröffnen Schülern den Zugang zur spannenden Welt der chemischen Wissenschaften!
In diesem Artikel
- EdrawMax: Die perfekte Plattform für chemische Bildung
-
- Destillation von Meerwasser 🌊 (Sekundarstufe I)
- Methan-Verbrennung: Chemische Reaktionsgleichung 🔥 (Sekundarstufe I)
- Nachweisreaktionen von Ammoniak 🧬 (Sekundarstufe I/II)
- Kupfer-Zyklus ⚙️ (Sekundarstufe I/II)
- SiO₄-Tetraeder-Raumstruktur 💎 (Sekundarstufe II)
- Phenol: Sulfonierung und Nitrierung 🔬 (Sekundarstufe II)
- Aluminiumgewinnung durch Schmelzflusselektrolyse ⚗️ (Sekundarstufe II)
- Benzimidazolon und Isoindolinon-Farbstoffe 🎨 (Sekundarstufe II)
- Synthese von Farbstoffen über Kondensationsreaktionen 🧪 (Sekundarstufe II)
- Übersichtliche Vergleichstabelle der Chemie-Vorlagen
-
- Chemie-didaktische Hinweise
- Differenzierungsmöglichkeiten im Chemieunterricht
- Digitale Integration in der Chemie
- Bewertungskriterien für Chemielernen
- EdrawMax im Chemieunterricht
- Praxisempfehlungen für chemische Bildung
- Fazit und Ausblick zur Chemie-Bildung
EdrawMax: Die perfekte Plattform für chemische Bildung
EdrawMax revolutioniert mit seiner benutzerfreundlichen und wissenschaftlich präzisen Diagramm-Software die Erstellung chemischer Lernmaterialien. Die Plattform verfügt über intuitive Benutzeroberflächen und speziell entwickelte Vorlagen für Reaktionsmechanismen, Apparaturen, Molekülstrukturen und industrielle Verfahren. Besonders beeindruckend ist die nahtlose Integration verschiedener Darstellungsformen – von detaillierten Versuchsaufbauten über präzise Strukturformeln bis hin zu faszinierenden Reaktionszyklen.
Im deutschen Schulkontext eröffnet EdrawMax Chemielehrkräften völlig neue Möglichkeiten: Vorlagen können schnell an spezifische Lehrplaninhalte angepasst werden, während Schüler über die kostenfreie Online-Version lernen, chemische Phänomene selbständig und kreativ zu visualisieren und zu verstehen. Die intelligenten Kollaborationsfunktionen fördern moderne MINT-Lernansätze und unterstützen sowohl experimentellen Präsenzunterricht als auch innovatives Fernlernen in der Chemie.
Detaillierte Vorlagen-Analyse
Die folgenden neun Chemie-Lernvorlagen sind nach Schwierigkeitsgrad angeordnet – vom ersten Naturwissenschafts-Kontakt in der Mittelstufe bis zu anspruchsvollen Oberstufen-Synthesen. Jede Vorlage öffnet uns ein neues Tor zum Verständnis der chemischen Welt!
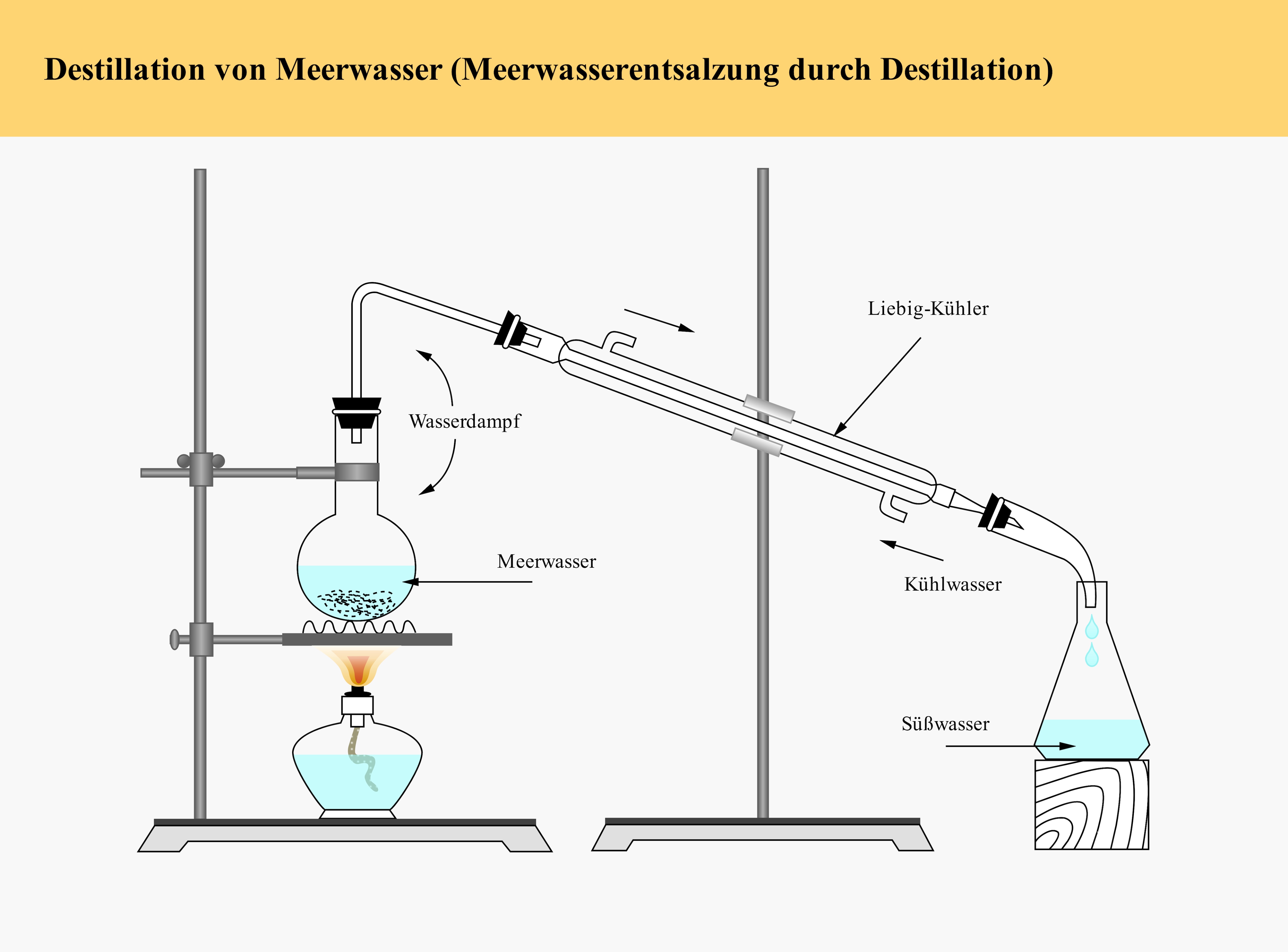
2.1 Destillation von Meerwasser 🌊
a) Vorlagenbeschreibung
Diese klassische Versuchsanordnung demonstriert die Trennung von Salzwasser durch Destillation. Der komplette Aufbau mit Heizquelle, Verdampfungskolben, Liebig-Kühler und Auffangbehälter zeigt alle Komponenten dieser fundamentalen Trennmethode. Ein perfektes Beispiel für nachhaltige Wasseraufbereitung und physikalisch-chemische Trennverfahren – Grundwissen für jeden Chemiker!
b) Wissenschaftliche Prinzipien
- Phasenübergänge verstehen: Verdampfung und Kondensation von Wasser
- Siedepunkte vergleichen: Reine Stoffe versus Salzlösungen
- Trennverfahren bewerten: Destillation versus andere Methoden
- Energiebilanz: Verdampfungsenthalpie und Kondensationswärme
- Praktische Anwendung: Meerwasserentsalzung in der Industrie
c) Schulkontext
Zielgruppe: Sekundarstufe I (Klassen 7-9), alle Schulformen
Lehrplanbezug: Perfekte Integration in die Curricula aller deutschen Bundesländer im Bereich "Trennverfahren und Stoffeigenschaften". Entspricht den KMK-Bildungsstandards für den Kompetenzbereich "Erkenntnisgewinnung".
Fächerintegration: Chemie (Hauptfach), Physik (Aggregatzustände), Geographie (Wasserkreislauf), Sachkunde (Umwelt)
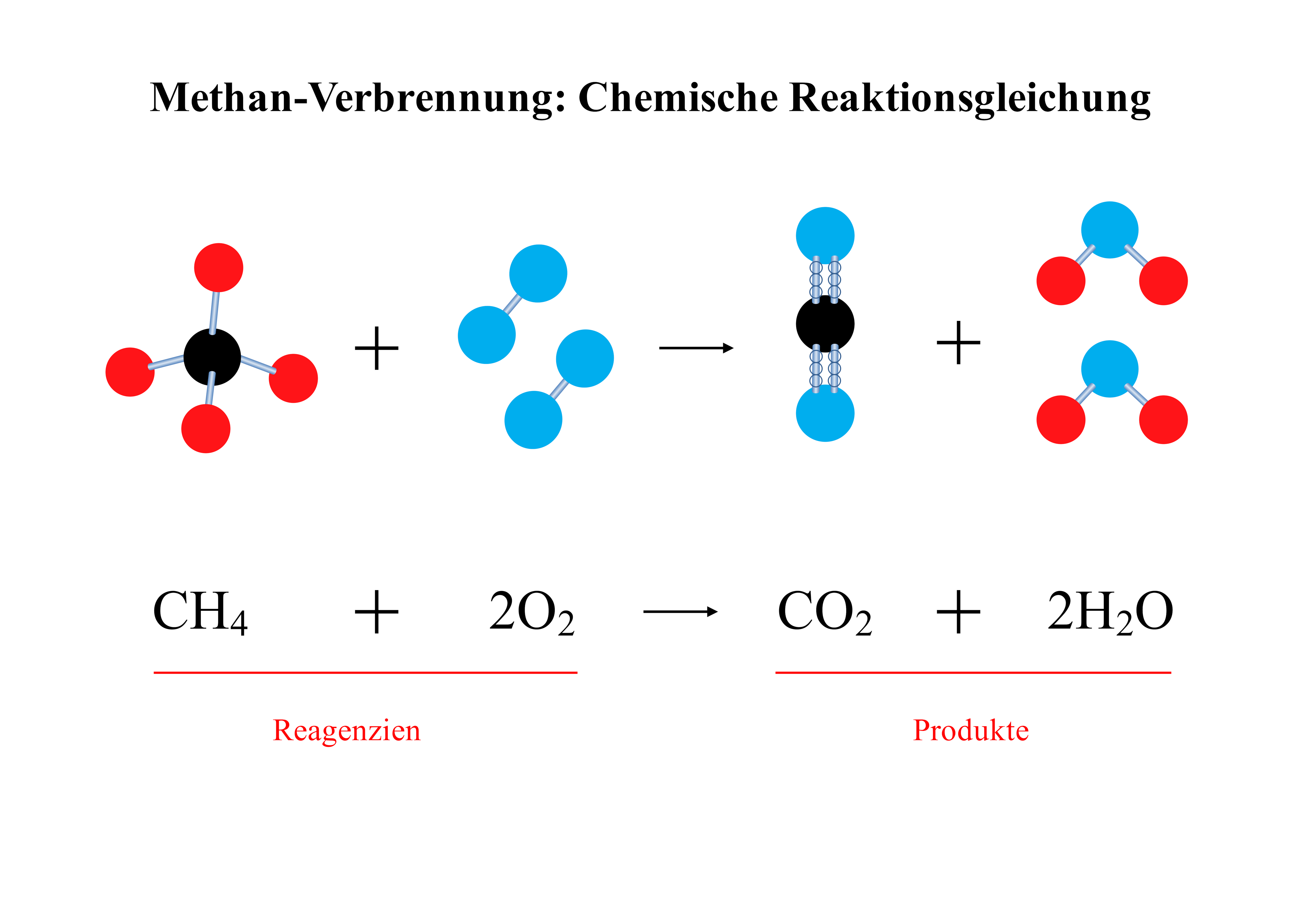
2.2 Methan-Verbrennung: Chemische Reaktionsgleichung 🔥
a) Vorlagenbeschreibung
Diese fundamental wichtige Reaktionsgleichung zeigt die vollständige Verbrennung von Methan sowohl auf molekularer als auch auf atomarer Ebene. Die 3D-Moleküldarstellung verdeutlicht die räumliche Anordnung und macht die Bindungsumordnung bei dieser exothermen Reaktion anschaulich verständlich. Ein klassisches Beispiel für Redoxreaktionen und Energieumwandlung!
b) Wissenschaftliche Prinzipien
- Stöchiometrie beherrschen: Quantitative Reaktionsgleichungen aufstellen
- Energieumsatz verstehen: Exotherme Verbrennungsreaktionen
- Oxidationszahlen: Elektronenübertragung bei Redoxreaktionen
- Umweltaspekte: CO₂-Bildung und Treibhauseffekt
- Reaktionskinetik: Aktivierungsenergie und Katalyse
c) Schulkontext
Zielgruppe: Sekundarstufe I (Klassen 8-10), alle Schulformen
Lehrplanbezug: Grundlegendes Element aller deutschen Bundesländer-Curricula im Bereich "Chemische Reaktionen". Zentral für MSA/Realschulabschluss in allen Bundesländern.
Fächerintegration: Chemie (Kernfach), Physik (Energielehre), Biologie (Zellatmung), Geographie (Klimawandel)
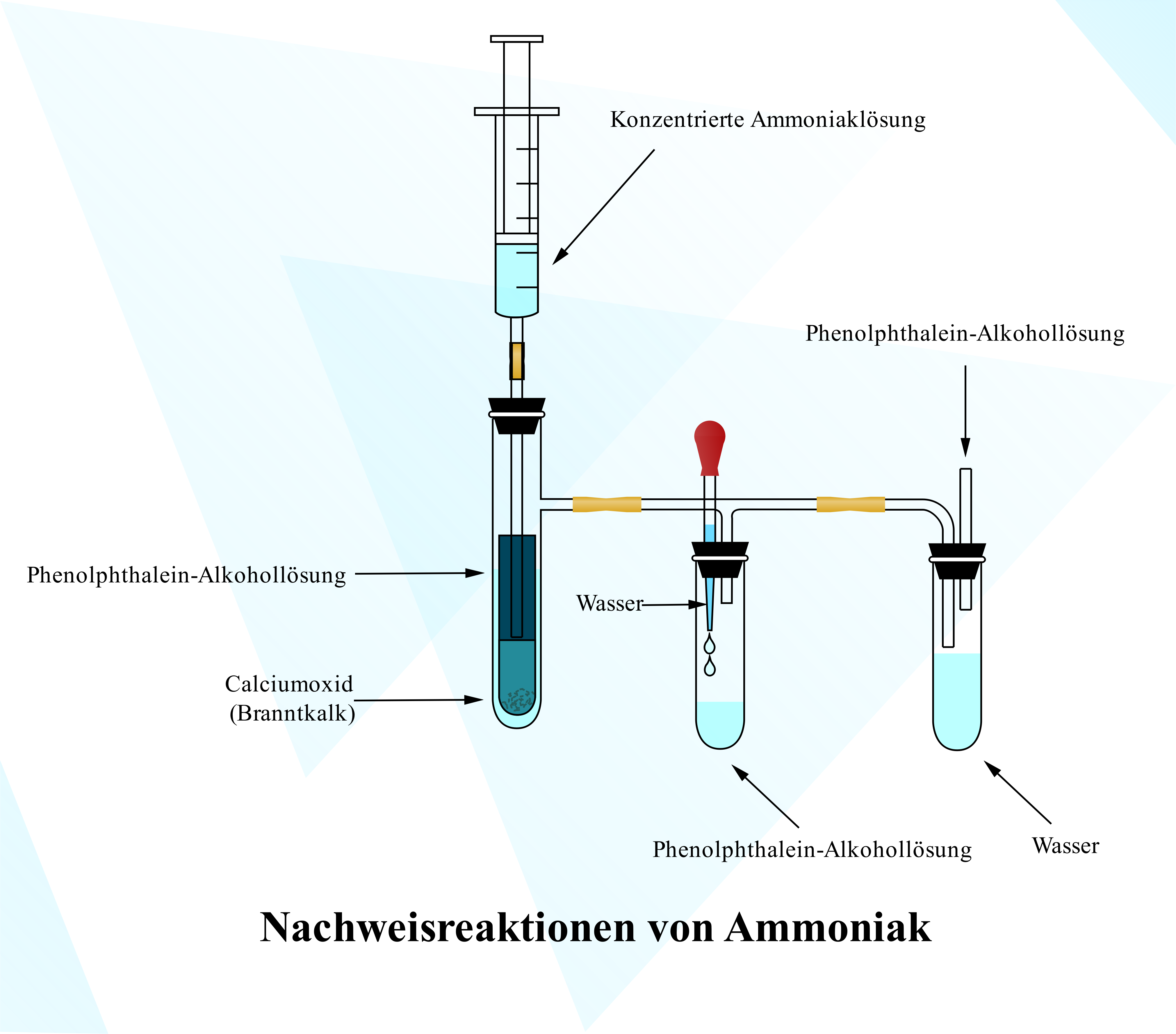
2.3 Nachweisreaktionen von Ammoniak 🧬
a) Vorlagenbeschreibung
Diese systematische Versuchsanordnung zeigt den klassischen Ammoniaknachweis mit Phenolphthalein. Durch Reaktion von Calciumoxid mit Ammoniaklösung entsteht gasförmiges Ammoniak, das in der Indikatorlösung eine charakteristische Rotfärbung bewirkt. Ein eleganter Nachweis für basische Gase und perfekte Einführung in die qualitative Analytik!
b) Wissenschaftliche Prinzipien
- Säure-Base-Reaktionen: Ammoniak als Lewis- und Brønsted-Base
- Indikatoren verstehen: pH-abhängige Farbumschläge
- Gasentwicklung: Reaktionen mit Gasbildung
- Qualitative Analyse: Nachweisreaktionen für Ionen und Moleküle
- Löslichkeitsgleichgewichte: Gas-Flüssig-Phasen
c) Schulkontext
Zielgruppe: Sekundarstufe I (Klassen 9-10), Sekundarstufe II
Lehrplanbezug: Kernbestandteil der Curricula aller Bundesländer im Bereich "Säuren und Basen". Besonders relevant für erweiterte Chemiekurse und Chemie-Leistungskurse.
Fächerintegration: Chemie (Hauptfach), Biologie (Stoffwechsel), Umweltwissenschaften (Stickstoffkreislauf)
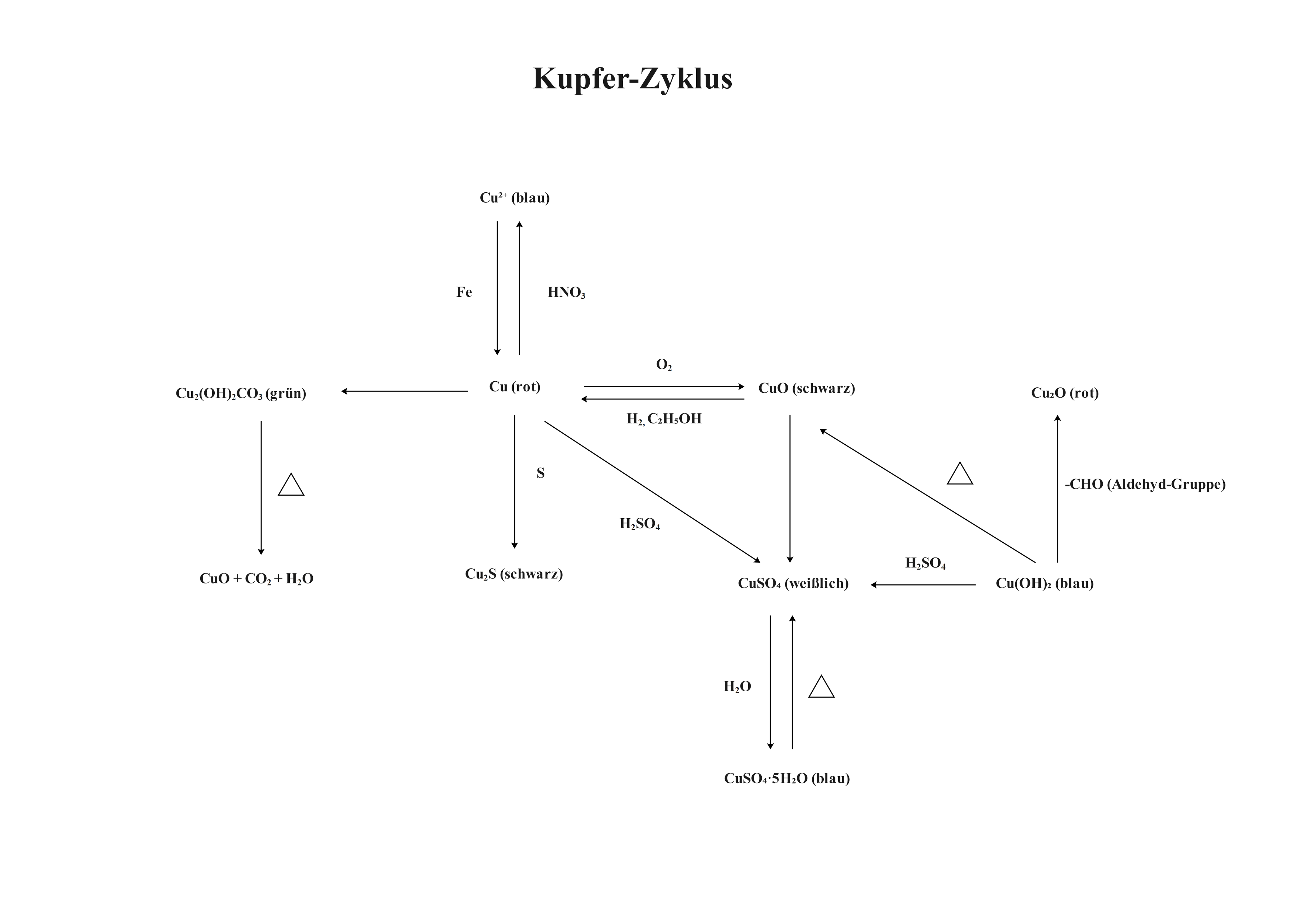
2.4 Kupfer-Zyklus ⚙️
a) Vorlagenbeschreibung
Dieser faszinierende Reaktionszyklus führt verschiedene Kupferverbindungen durch systematische Oxidations- und Reduktionsschritte wieder zum Ausgangsstoff zurück. Von metallischem Kupfer über Kupferoxid, Kupfersulfat bis zu Kupferhydroxid – jeder Schritt demonstriert fundamentale anorganische Reaktionen und Redoxprozesse. Ein Meisterwerk der präparativen Chemie!
b) Wissenschaftliche Prinzipien
- Redoxreaktionen verstehen: Oxidation und Reduktion von Kupfer
- Fällungsreaktionen: Bildung schwerlöslicher Verbindungen
- Komplexbildung: Kupfer-Ionen in wässriger Lösung
- Thermische Zersetzung: Temperaturabhängige Reaktionen
- Stoffkreisläufe: Recycling in der Natur und Technik
c) Schulkontext
Zielgruppe: Sekundarstufe I/II (Klassen 9-12), alle Profile
Lehrplanbezug: Klassischer Bestandteil aller deutschen Bundesländer-Curricula im Bereich "Redoxreaktionen". Hochrelevant für das Abitur in allen Bundesländern.
Fächerintegration: Chemie (Anorganik), Physik (Elektrochemie), Technik (Metallurgie), Wirtschaft (Rohstoffkreisläufe)
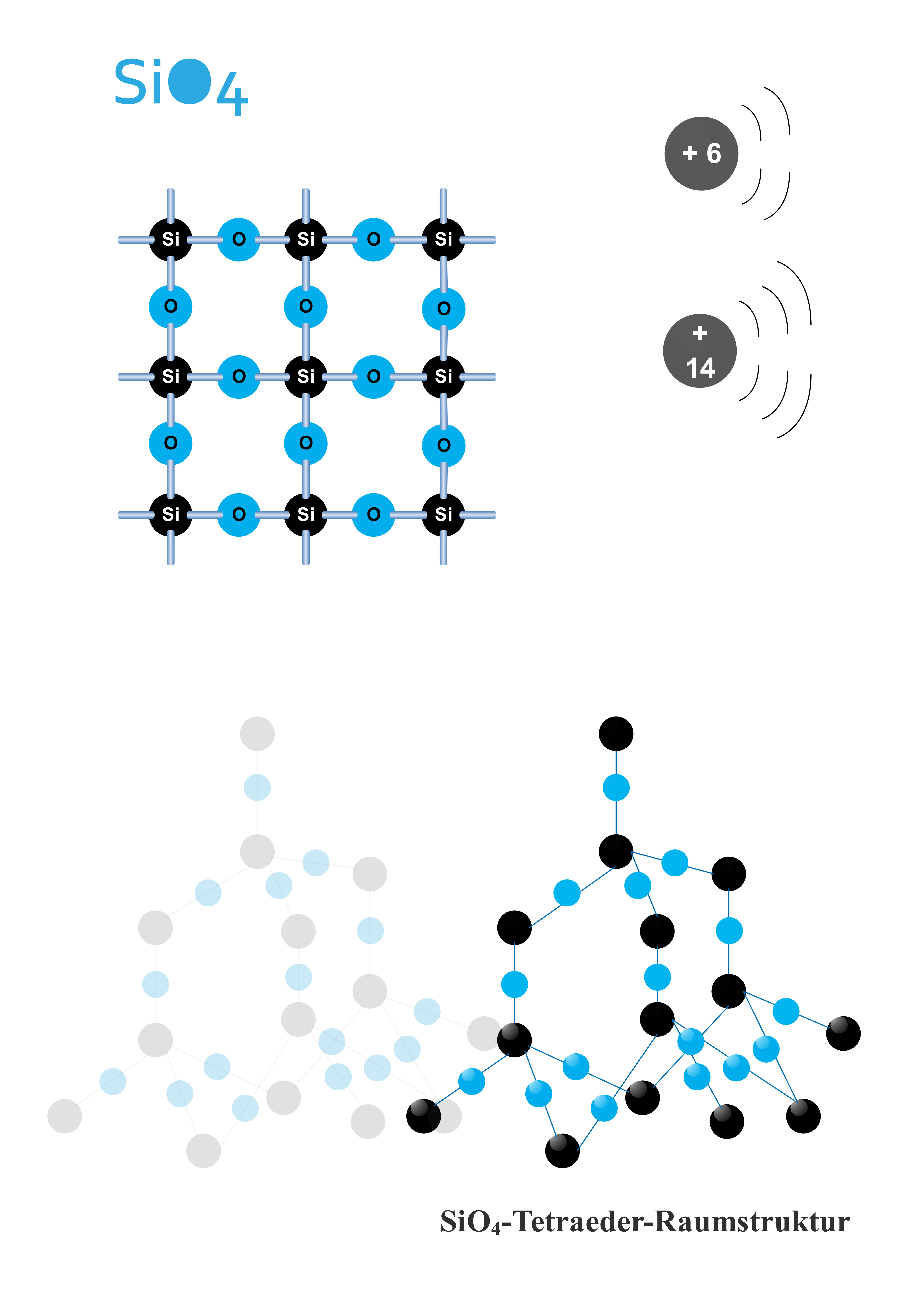
2.5 SiO₄-Tetraeder-Raumstruktur 💎
a) Vorlagenbeschreibung
Diese dreidimensionale Darstellung zeigt die fundamentale Baueinheit aller Silikate: das SiO₄-Tetraeder. Die räumliche Anordnung mit dem zentralen Silizium-Atom und den vier Sauerstoff-Atomen an den Ecken erklärt die Vielfalt der Silikatstrukturen von Quarz über Feldspat bis zu komplexen Schichtsilikaten. Grundlage der Kristallchemie und Materialwissenschaften!
b) Wissenschaftliche Prinzipien
- VSEPR-Theorie anwenden: Molekülgeometrie aus Elektronenabstoßung
- Hybridisierung verstehen: sp³-Hybridorbitale des Siliziums
- Kristallstrukturen: Verknüpfung von Tetraeder-Einheiten
- Materialwissenschaft: Struktur-Eigenschafts-Beziehungen
- Geochemie: Mineralbildung und Gesteinsaufbau
c) Schulkontext
Zielgruppe: Sekundarstufe II (Klassen 11-13), Chemie-LK
Lehrplanbezug: Erweiterte Inhalte der Bundesländer-Curricula im Bereich "Molekülgeometrie und Festkörperchemie". Besonders relevant für naturwissenschaftliche Abiturprofile.
Fächerintegration: Chemie (Strukturchemie), Physik (Festkörperphysik), Geographie (Mineralogie), Mathematik (Raumgeometrie)
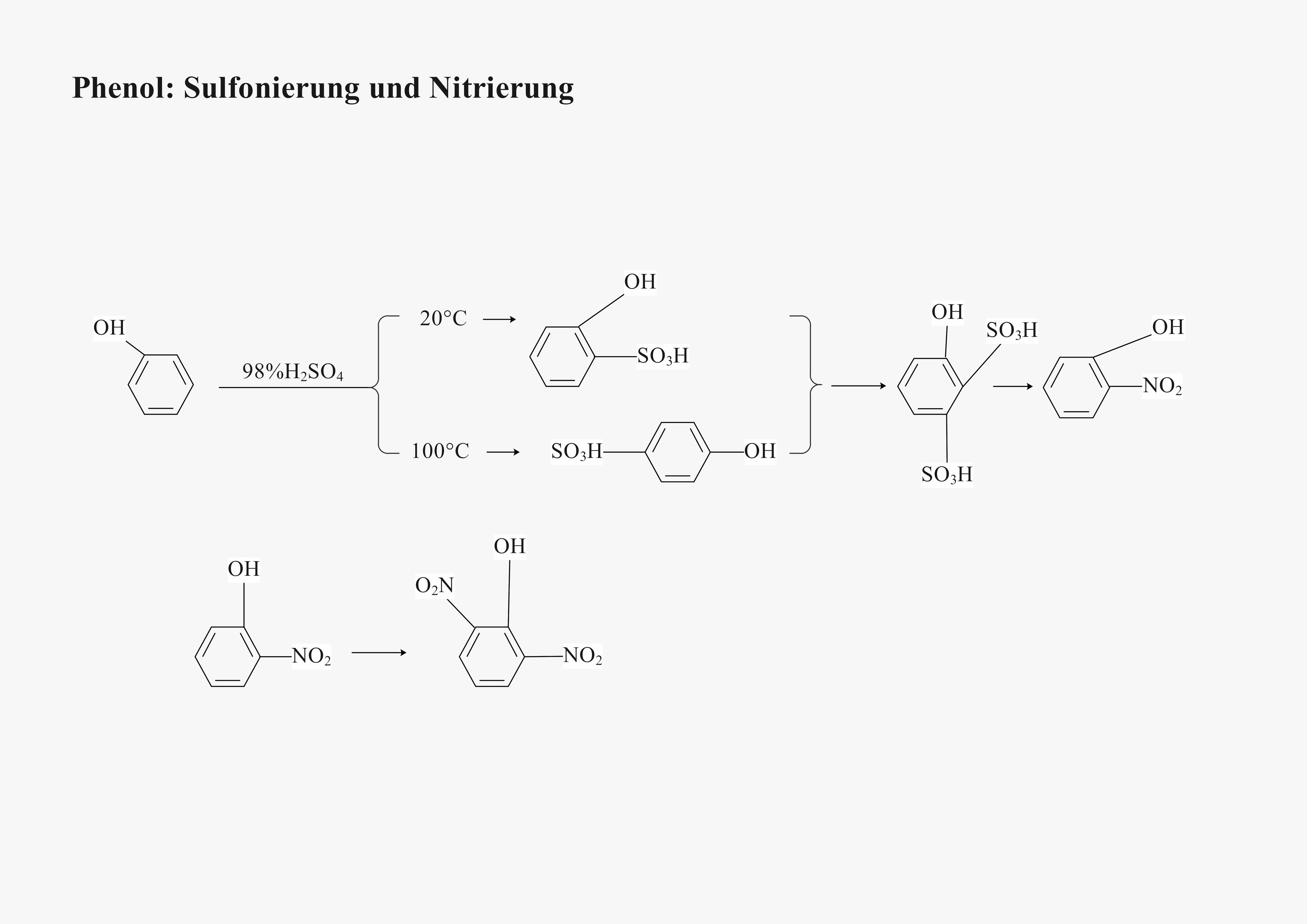
2.6 Phenol: Sulfonierung und Nitrierung 🔬
a) Vorlagenbeschreibung
Diese Reaktionssequenz zeigt die elektrophile aromatische Substitution am Phenol-Molekül. Zunächst erfolgt die Sulfonierung mit konzentrierter Schwefelsäure, gefolgt von der Nitrierung. Die dirigierende Wirkung der OH-Gruppe zu ortho- und para-Positionen wird deutlich visualisiert – ein Klassiker der Aromatenchemie und Grundlage der organischen Synthese!
b) Wissenschaftliche Prinzipien
- Elektrophile Substitution: Mechanismus der SE-Ar-Reaktionen
- Dirigierende Effekte: +M-Effekt der OH-Gruppe
- Regioselektivität: ortho/para-Dirigierung verstehen
- Reaktivität bewerten: Aktivierung des Aromaten durch Substituenten
- Syntheseplanung: Selektive Funktionalisierung
c) Schulkontext
Zielgruppe: Sekundarstufe II (Klassen 12-13), Chemie-LK
Lehrplanbezug: Anspruchsvolle Inhalte aller deutschen Bundesländer-Curricula im Bereich "Aromatenchemie". Zentral für das Chemie-Abitur mit erhöhtem Anforderungsniveau.
Fächerintegration: Chemie (Organik), Biologie (Phenolverbindungen), Medizin (Arzneistoffchemie), Technik (Kunststoffchemie)
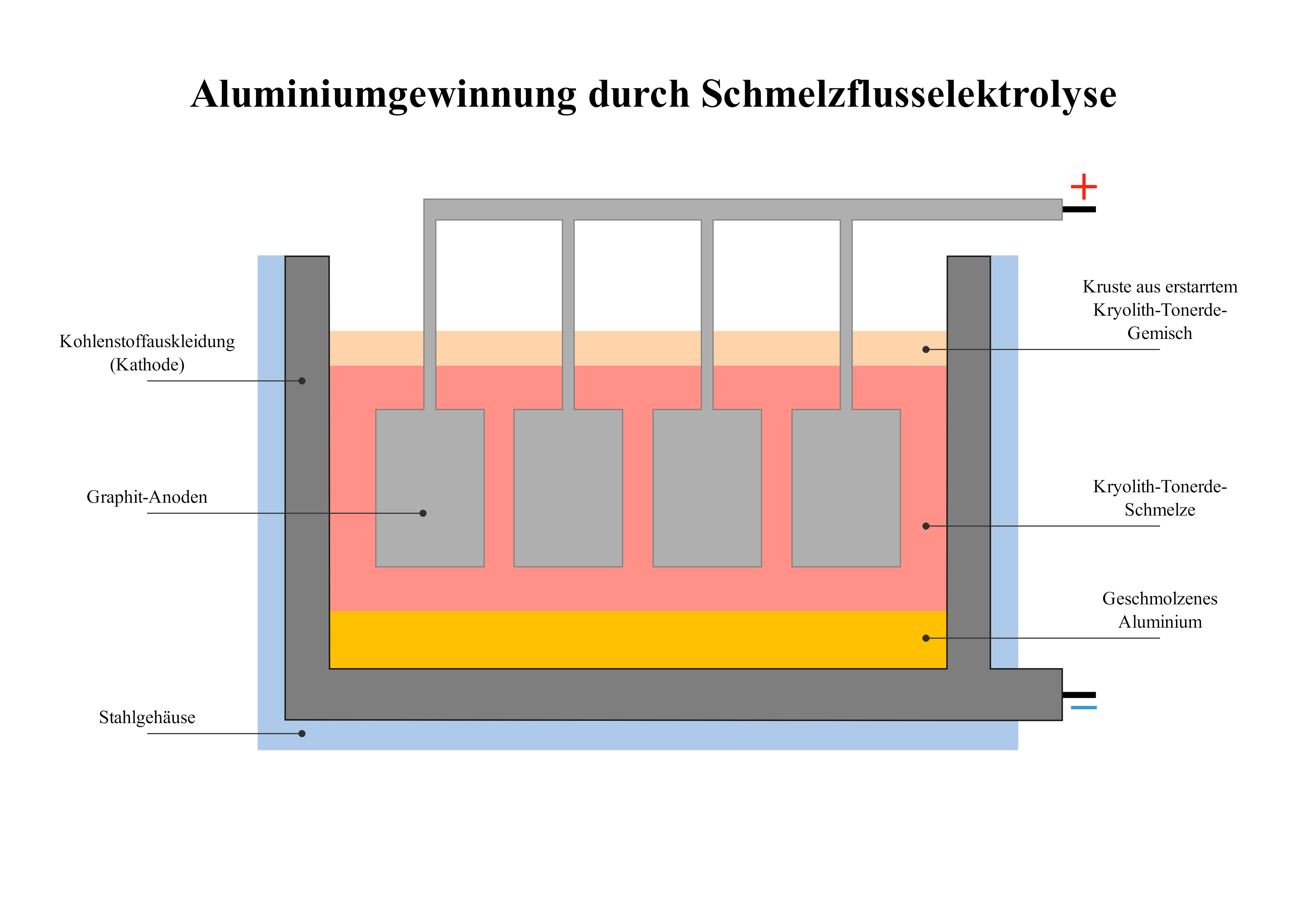
2.7 Aluminiumgewinnung durch Schmelzflusselektrolyse ⚗️
a) Vorlagenbeschreibung
Diese technisch präzise Darstellung zeigt das Hall-Héroult-Verfahren zur industriellen Aluminiumgewinnung. Die Elektrolysezelle mit Graphitanoden und -kathode, gefüllt mit geschmolzenem Kryolith-Tonerde-Gemisch bei 950°C, verdeutlicht eindrucksvoll die komplexe Reduktion von Al₂O₃ zu reinem Aluminium. Ein perfektes Beispiel für industrielle Elektrochemie und nachhaltiges Metallrecycling!
b) Wissenschaftliche Prinzipien
- Elektrolyse verstehen: Reduktion von Al³⁺-Ionen an der Kathode
- Faradaysche Gesetze anwenden: Quantitative Elektrolyse-Berechnungen
- Schmelzpunkt-Erniedrigung: Kryolith als Flussmittel
- Energiebilanz analysieren: Hochtemperaturprozesse und Stromverbrauch
- Industrielle Verfahrenstechnik: Großtechnische Umsetzung
c) Schulkontext
Zielgruppe: Sekundarstufe II (Klassen 11-13), Chemie-Leistungskurse
Lehrplanbezug: Hochanspruchsvolle Inhalte der experimentellen Chemie als Teil aller deutschen Bundesländer-Oberstufencurricula. Besonders relevant für praxisorientierte Abiturprüfungen und Experimentalklausuren.
Fächerintegration: Chemie (Elektrochemie), Physik (Elektrizitätslehre), Technik (Verfahrenstechnik), Wirtschaft (Rohstoffgewinnung)
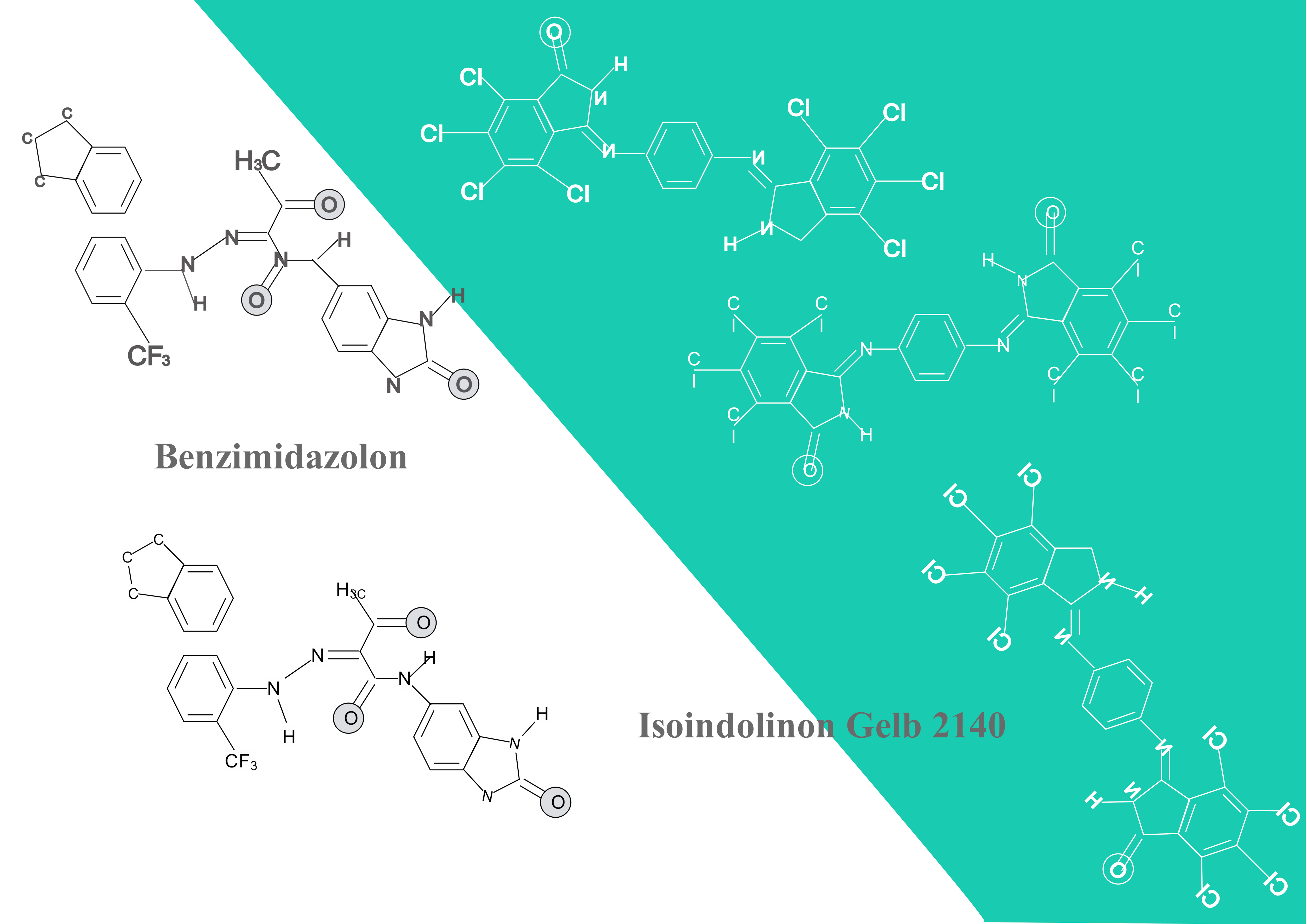
2.8 Benzimidazolon und Isoindolinon-Farbstoffe 🎨
a) Vorlagenbeschreibung
Diese strukturchemisch detaillierte Darstellung zeigt zwei hochmoderne organische Pigmentklassen. Die komplexen Molekülstrukturen mit ihren konjugierten Systemen erklären die außergewöhnliche Farbintensität und Lichtechtheit. Perfekt für das Verständnis von Struktur-Eigenschafts-Beziehungen in der organischen Chemie und Einblick in modernste Materialforschung!
b) Wissenschaftliche Prinzipien
- Konjugierte Systeme: Elektronendelokalisierung und Farbigkeit
- Chromophore verstehen: Lichtabsorption und Farbwahrnehmung
- Mesomerie-Effekte: Resonanzstrukturen in Farbstoffmolekülen
- Stabilität bewerten: Licht- und Wetterbeständigkeit
- Moleküldesign: Gezielte Eigenschaftsoptimierung
c) Schulkontext
Zielgruppe: Sekundarstufe II (Klassen 12-13), Chemie-LK
Lehrplanbezug: Spezialisierte Inhalte der organischen Chemie in erweiterten Kursen aller Bundesländer. Besonders relevant für forschungsorientierte Projekte und W-Seminararbeiten in Bayern.
Fächerintegration: Chemie (Organik), Physik (Optik), Kunst (Farbenlehre), Technik (Materialwissenschaften)
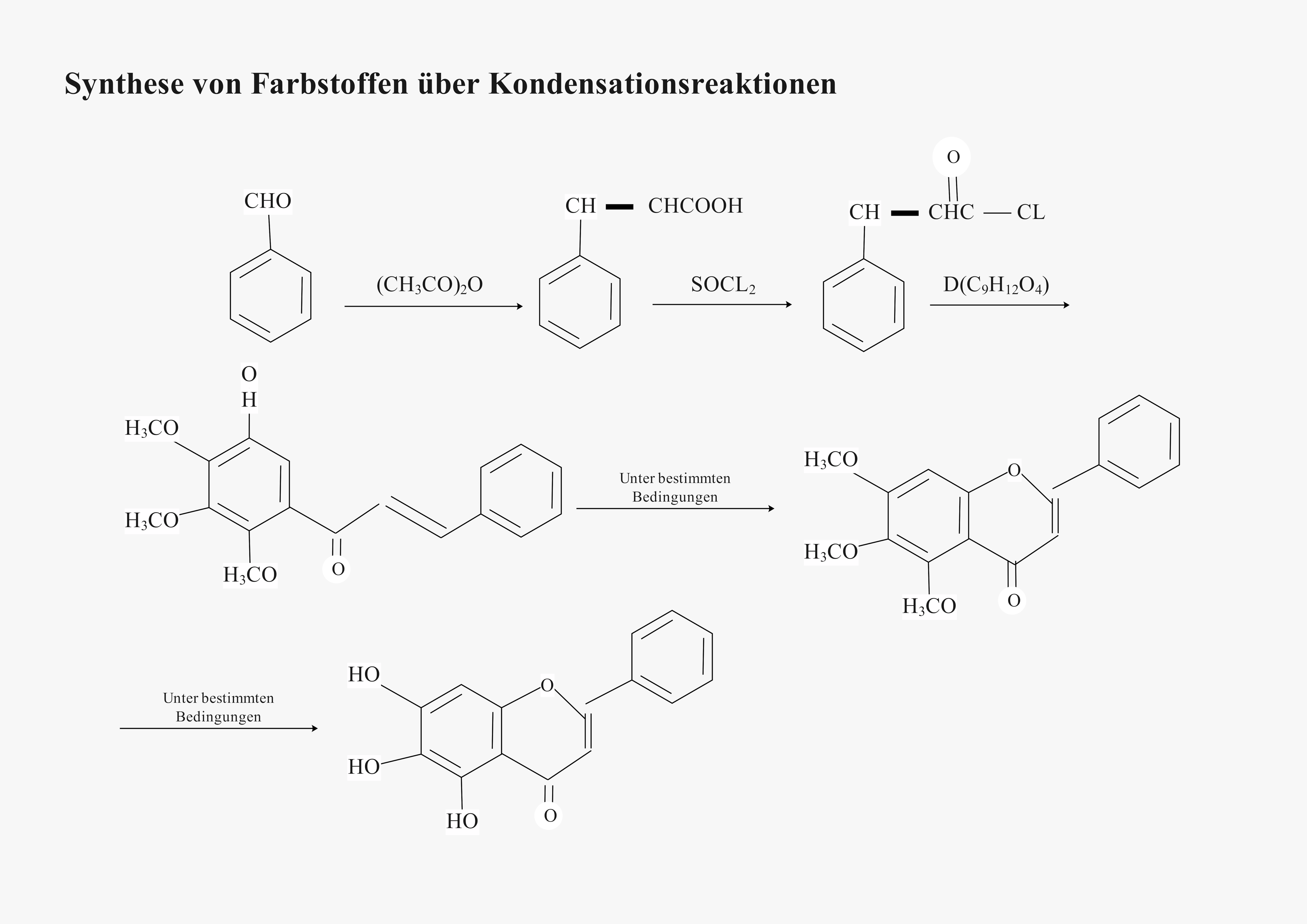
2.9 Synthese von Farbstoffen über Kondensationsreaktionen 🧪
a) Vorlagenbeschreibung
Diese mehrstufige Reaktionssequenz demonstriert die elegante Synthese komplexer Farbstoffmoleküle. Ausgehend von Benzaldehyd führen systematische Kondensationsreaktionen über Zwischenstufen zu hochkonjugierten Flavon-Derivaten. Ein brillantes Beispiel für synthetische Strategien in der organischen Chemie und moderne Präparationstechniken!
b) Wissenschaftliche Prinzipien
- Kondensationsreaktionen: C-C-Knüpfung unter Wasserabspaltung
- Reaktionsmechanismen: Elektrophile und nukleophile Angriffe
- Syntheseplanung: Retrosynthetische Analyse
- Reinigung verstehen: Kristallisation und Umkristallisation
- Multistep-Synthese: Komplexe Syntheserouten planen
c) Schulkontext
Zielgruppe: Sekundarstufe II (Klassen 12-13), Chemie-LK
Lehrplanbezug: Höchstanspruchsvolle Inhalte für experimentell orientierte Chemie-Leistungskurse in allen Bundesländern. Perfekt für praktische Abiturprüfungen und Forschungsprojekte.
Fächerintegration: Chemie (Synthesechemie), Biologie (Naturstoffe), Physik (Spektroskopie), Mathematik (Statistik)
Übersichtliche Vergleichstabelle der Chemie-Vorlagen
| Chemie-Vorlage | Zielgruppe | Teilgebiet | Schwierigkeitsgrad | Experimenteller Aufwand | Abitur-Relevanz | Zentrale Lernziele |
|---|---|---|---|---|---|---|
| 🌊 Meerwasser-Destillation | Sek I (7-9) | Trennverfahren | ⭐ Niedrig | Schülerversuch | Grundwissen | Phasenübergänge verstehen, Trennmethoden anwenden |
| 🔥 Methan-Verbrennung | Sek I (8-10) | Grundlagen | ⭐ Niedrig | Demonstration | Grundwissen | Reaktionsgleichungen aufstellen, Energieumsatz erfassen |
| 🧬 Ammoniak-Nachweis | Sek I/II (9-12) | Säure-Base | ⭐⭐ Mittel | Schülerversuch | Qualitative Analyse | Nachweisreaktionen durchführen, pH-Konzept anwenden |
| ⚙️ Kupfer-Zyklus | Sek I/II (9-12) | Redox | ⭐⭐ Mittel | Lehrerversuch | Elektrochemie | Redoxreaktionen verstehen, Stoffkreisläufe erkennen |
| 💎 SiO₄-Tetraeder | Sek II (11-13) | Struktur | ⭐⭐⭐ Mittel-Hoch | Modellbau | Molekülgeometrie | VSEPR-Theorie anwenden, Raumstrukturen verstehen |
| 🔬 Phenol-Substitution | Sek II (12-13) | Organik | ⭐⭐⭐ Hoch | Lehrerversuch | Aromatenchemie | Elektrophile Substitution beherrschen, Dirigierung verstehen |
| ⚗️ Aluminium-Gewinnung | Sek II (11-13) | Elektrochemie | ⭐⭐⭐⭐ Hoch | Industrieverfahren | Elektrolyse | Faradaysche Gesetze anwenden, technische Chemie verstehen |
| 🎨 Farbstoffstrukturen | Sek II (12-13) | Organik | ⭐⭐⭐⭐ Hoch | Theoretisch | Struktur-Eigenschaft | Konjugierte Systeme verstehen, Moleküldesign anwenden |
| 🧪 Farbstoff-Synthese | Sek II (12-13) | Organik | ⭐⭐⭐⭐⭐ Sehr Hoch | Mehrstufig | Synthesechemie | Komplexe Synthesen planen, Reaktionsmechanismen verstehen |
Praxisnahe Empfehlungen für maximalen Lernwert
4.1 Chemie-didaktische Hinweise
Experimenteller Chemieunterricht
- Phänomen-orientierter Einstieg: Vom Staunen zur systematischen Erklärung
- Hypothesenbildung: Schüler entwickeln eigene Erklärungsmodelle
- Quantitative Auswertung: Messdaten systematisch analysieren und interpretieren
- Modell-Realitätsbezug: Grenzen und Gültigkeitsbereiche chemischer Modelle
MINT-Förderung nach deutschen Standards
- Integration der KMK-Bildungsstandards für naturwissenschaftliche Grundbildung
- Förderung prozessbezogener Kompetenzen (Erkenntnisgewinnung, Kommunikation, Bewertung)
- Behandlung gesellschaftsrelevanter Themen nach Beutelsbacher Konsens
- Vernetzung mit außerschulischen MINT-Lernorten und Schülerlaboren
4.2 Differenzierungsmöglichkeiten im Chemieunterricht
Niveaudifferenzierung in der Chemie
- Qualitativ versus quantitativ: Phänomene verstehen oder mathematisch modellieren
- Experimentelle Ansätze: Vom angeleiteten Versuch zur freien Forschung
- Grad der Mathematisierung: Beschreibung, Formelanwendung oder Herleitung
Inklusive Chemie-Didaktik
- Multisensorischer Zugang: Chemische Phänomene sehen, riechen, fühlen
- Sprachsensibler Fachunterricht: Systematischer Aufbau der Fachsprache
- Gendersensible Chemie: Vielfältige Kontexte und Rollenvorbilder
- Begabtenförderung: Forschungsprojekte und Wettbewerbsteilnahmen
4.3 Digitale Integration in der Chemie
Digitale Experimentalchemie
- Molekülvisualisierung: 3D-Darstellung komplexer Strukturen
- Simulationssoftware: ChemSketch, Avogadro und andere Modellierungstools
- Messtechnik: Sensoren und digitale Datenerfassung in Experimenten
- VR/AR-Anwendungen: Immersive Laborerfahrungen und Molekülexploration
Kollaborative MINT-Bildung
- Digitale Laborjournale und gemeinsame Datenauswertung
- Internationale Schulkooperationen für gemeinsame Projekte
- Online-Mentoring durch Universitäten und Forschungseinrichtungen
- Citizen-Science-Projekte mit echten Forschungsdaten
- EdrawMax-Integration: Kollaborative Erstellung von Reaktionsschemata
- Gemeinsame chemische Mind-Maps für vernetzte Fachbereiche
4.4 Bewertungskriterien für Chemielernen
Kompetenzorientierte Chemiebewertung
- Erkenntnisgewinnung (35%): Experimentieren, Modellieren, Mathematisieren
- Fachwissen (30%): Konzepte, Prinzipien und Gesetzmäßigkeiten
- Kommunikation (20%): Fachsprache, Argumentation, Präsentation
- Bewertung (15%): Relevanz, Nachhaltigkeit, ethische Aspekte
Bewertung experimenteller Fähigkeiten
- Versuchsplanung und Hypothesenformulierung
- Durchführung und Protokollierung von Experimenten
- Datenauswertung und Fehleranalyse
- Kritische Reflexion von Ergebnissen und Methoden
Chemiespezifische Qualitätssicherung
- Fachliche Richtigkeit und Aktualität der Inhalte
- Sicherheitsaspekte beim Experimentieren beachten
- Vernetzung mit aktueller Forschung und Technik
- Berücksichtigung von Forschungsethik und Nachhaltigkeit
4.5 EdrawMax im Chemieunterricht
Revolutionäre Vorteile für Chemielehrkräfte
- Reaktionsmechanismen: Komplexe Reaktionswege visualisieren
- Apparaturen-Design: Präzise Versuchsaufbauten in Minuten erstellen
- Molekülstrukturen: 2D- und 3D-Darstellungen organischer Verbindungen
- Prozessdiagramme: Industrielle Verfahren perfekt darstellen
- Stoffkreisläufe: Umweltchemie und Nachhaltigkeit veranschaulichen
Inspirierender Mehrwert für Chemieschüler
- Concept-Maps: Chemische Zusammenhänge visuell strukturieren
- Reaktionsschemata: Synthesewege systematisch dokumentieren
- Laborprotokolle: Professionelle Darstellung von Versuchsergebnissen
- Modellentwicklung: Eigene chemische Modelle kreativ visualisieren
- Portfolio-Design: Lernfortschritte ansprechend dokumentieren
MINT-Integration im deutschen Bildungssystem
- Unterstützung der MINT-Strategie des Bundesbildungsministeriums
- Förderung digitaler Kompetenzen nach KMK-Strategie "Bildung in der digitalen Welt"
- Vorbereitung auf technische Studiengänge und Ingenieurberufe
- Stärkung Deutschlands als Technologie- und Innovationsstandort
- Beitrag zur Chancengleichheit in MINT-Fächern
4.6 Praxisempfehlungen für chemische Bildung
Chemiespezifische Unterrichtsszenarien
- Experimenteinführung: Phänomene mit EdrawMax-Diagrammen erklären
- Modellierung: Theoretische Konzepte visuell entwickeln
- Versuchsauswertung: Messdaten in aussagekräftige Diagramme umwandeln
- Forschungsprojekte: Kollaborative Modellierung komplexer chemischer Systeme
- Abiturvorbereitung: Systematische Visualisierung prüfungsrelevanter Themen
Technische Integration im Chemieunterricht
- Interaktive Whiteboards für Echtzeit-Diagrammerstellung
- Tablet-Klassen für mobile Versuchsdokumentation
- 3D-Drucker für EdrawMax-designte physische Modelle
- Sensor-Interfaces für direkte Messdaten-Visualisierung
- Cloud-Storage für fachübergreifende Projektarbeit
MINT-Vernetzung und Weiterbildung
- Kooperationen mit Universitäten und Forschungseinrichtungen
- Lehrerfortbildungen zu digitaler Chemie-Didaktik
- Schülerlabor-Partnerschaften für authentische Forschungserfahrungen
- Industriekooperationen für praxisnahe Anwendungsbeispiele
- Internationale MINT-Projekte mit Partnerschulen
Fazit und Ausblick zur Chemie-Bildung
Die vorgestellten neun Chemie-Lernvorlagen, meisterhaft erstellt mit EdrawMax, decken das gesamte Spektrum chemischer Bildung ab – von fundamentalen Trennverfahren der Mittelstufe bis zu anspruchsvollen organischen Synthesen der Oberstufe. Alle Vorlagen entsprechen den aktuellen Bildungsstandards aller deutschen Bundesländer und schaffen durch die systematische Integration digitaler Medien, experimenteller Zugänge und kompetenzorientierter Bewertungsverfahren optimale Lernbedingungen für eine fundierte chemische Grundbildung.